Cet article est PREMIUM, et nécessite un abonnement payant pour lire la suite
Créez votre compte dès maintenant puis contactez-nous pour accéder aux articles Premium et/ou Lettre Export.
Temps estimé - 3 min
Céline Le Stunff.
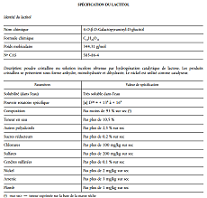 En mars 2015, la société DuPont Nutrition Biosciences ApS a introduit auprès des autorités danoises une demande de mise sur le marché UE du lactitol en tant que nouvel ingrédient alimentaire. La société propose qu’il soit utilisé dans les mêmes catégories de denrées alimentaires et dans les mêmes quantités que lorsqu’il est utilisé en tant qu’additif alimentaire, au titre de l’annexe II du règlement (CE) n°1333/2008.
En mars 2015, la société DuPont Nutrition Biosciences ApS a introduit auprès des autorités danoises une demande de mise sur le marché UE du lactitol en tant que nouvel ingrédient alimentaire. La société propose qu’il soit utilisé dans les mêmes catégories de denrées alimentaires et dans les mêmes quantités que lorsqu’il est utilisé en tant qu’additif alimentaire, au titre de l’annexe II du règlement (CE) n°1333/2008.
En juillet 2015, l’évaluation danoise arrive à la conclusion que le lactitol, dans les conditions d’utilisation proposées, satisfaisait aux critères applicables aux nouveaux ingrédients. Certains États membres ont cependant formulé des inquiétudes quant à une consommation de lactitol excessive et à un risque d’induire le consommateur en erreur en raison de l’autorisation déjà accordée en tant qu’additif alimentaire, pour les mêmes utilisations et dans les mêmes quantités.
Ceci a conduit à limiter l’utilisation du lactitol aux compléments alimentaires. Sans préjudice de la directive 2002/46/CE, le lactitol, peut donc être mis sur le marché UE en tant que nouvel ingrédient dans les compléments alimentaires pour adultes, sous forme de gélules ou de comprimés, à la dose maximale de 20 g de lactitol par jour.









